Mới đây, Sở Y tế Hà Nội thông báo khẩn thu hồi thuốc Viên nang cứng Dicellnase (Piroxicam 20mg), SĐK VN-19810-16, số lô sản xuất D1072, ngày sản xuất 11/2023, hạn dùng 11/2026.
Thuốc Viên nang cứng Dicellnase (Piroxicam 20mg) do Công ty TNHH Thương mại Nam Đồng nhập khẩu và phân phối.
Lý do thu hồi do mẫu thuốc không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan, vi phạm mức độ 3. Mẫu thuốc do Trung tâm Kiểm nghiệm thuốc, mỹ phẩm, thực phẩm Hà Nội lấy tại Bệnh viện Đa khoa Quốc Oai.

Viên nang cứng Dicellnase (Piroxicam 20mg), số lô D1072 bị cơ quan chức năng thu hồi - Ảnh phapluatplus
Sở Y tế Hà Nội yêu cầu Công ty TNHH Thương mại Nam Đồng trong thời hạn 2 ngày kể từ ngày ký công văn thu hồi, gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc Viên nang cứng Dicellnase; Tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên tại địa bàn thành phố Hà Nội và các cơ sở kinh doanh, sử dụng thuốc do đơn vị này cung cấp.
Công ty phải gửi báo cáo thu hồi về Cục Quản lý Dược, Sở Y tế Hà Nội trong thời hạn 18 ngày kể từ ngày ký công văn, bao gồm về số lượng nhập, số lượng phân phối, số lượng thu hồi trên địa bàn Hà Nội, các bằng chứng về việc thực hiện thu hồi tại cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định hiện hành.
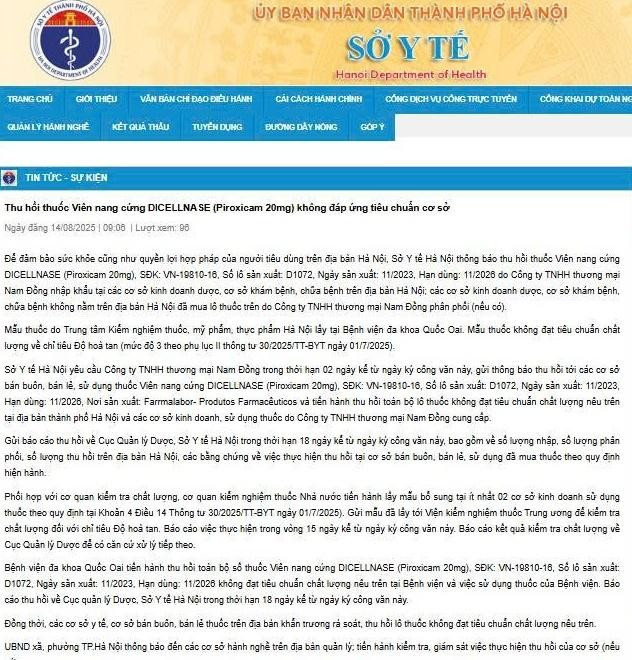
Thông báo của Sở Y tế Hà Nội thu hồi thuốc Viên nang cứng Dicellnase (Piroxicam 20mg)/Ảnh chụp màn hình
Đối với Bệnh viện Đa khoa Quốc Oai, Sở Y tế yêu cầu thu hồi toàn bộ lượng thuốc vi phạm đang lưu hành tại bệnh viện, đồng thời báo cáo chi tiết tình hình sử dụng và kết quả thu hồi trong hạn 18 ngày.
Tất cả cơ sở y tế, nhà thuốc bán buôn, bán lẻ trên địa bàn Hà Nội phải khẩn trương rà soát và thu hồi ngay lô thuốc D1072 không đạt chuẩn. UBND xã, phường có trách nhiệm thông báo tới các cơ sở hành nghề, kiểm tra và giám sát chặt chẽ quá trình thực hiện thu hồi thuốc.